इस पोस्ट में हम metals and non metals class 10 solutions notes in hindi धातु एवं अधातु के बारे में चर्चा कर रहे हैं। यदि आपके पास इस अध्याय से संबंधित कोई प्रश्न है तो आप कमेंट बॉक्स में टिप्पणी करें
यह पोस्ट बिहार बोर्ड परीक्षा के दृष्टिकोण से बहुत महत्वपूर्ण है। इसे पढ़ने से आपकी पुस्तक के सभी प्रश्न आसानी से हल हो जायेंगे। इसमें सभी पाठों के अध्यायवार नोट्स उपलब्ध कराये गये हैं। सभी विषयों को आसान भाषा में समझाया गया है।
ये नोट्स पूरी तरह से NCERTऔर SCERT बिहार पाठ्यक्रम पर आधारित हैं। इसमें विज्ञान के प्रत्येक पाठ को समझाया गया है, जो परीक्षा की दृष्टि से बहुत महत्वपूर्ण है। इस पोस्ट को पढ़कर आप बिहार बोर्ड कक्षा 10 विज्ञान के किसी भी पाठ को आसानी से समझ सकते हैं और उस पाठ के प्रश्नों का उत्तर दे सकते हैं।
metals and non metals class 10 solutions notes in hindi Bihar Board NCERT धातु एवं अधातु

Who is the father of Science in hindi | विज्ञान के जनक
धातु :
धातु वे तत्व हैं जो विद्युत धनात्मक लचीले, लचीले और गर्मी और बिजली के उत्कृष्ट संवाहक होते हैं, और चमकदार और कठोर होते हैं जिन्हें धातु कहा जाता है। जैसे- सोडियम, मैग्नीशियम, जिंक, सीसा, तांबा, तांबा, सोना, एल्युमिनियम आदि।
अधातु:
वे तत्व जो विद्युत धनात्मक, लचीले, लचीले और बिजली और गर्मी के अच्छे संवाहक, चमकदार और कठोर नहीं होते हैं, उन्हें गैर-धातु के रूप में जाना जाता है। जैसे- कार्बन, सल्फर, आयोडीन, क्लोरीन, ऑक्सीजन, नाइट्रोजन आदि।
धातुओं के भौतिक गुण
- धातुओं की विद्युत धनात्मक प्रकृति स्पष्ट है।
- धातुओं में लचीलापन होता है।
- धातुएँ लोचदार होती हैं।
- धातुओं में उच्च क्वथनांक और गलनांक होते हैं।
- धातुएँ ऊष्मा और विद्युत की उत्कृष्ट सुचालक होती हैं।
- धातुओं में अनोखी तरह की चमक होती है।
- धातुएँ अत्यंत कठोर होती हैं।
- जब धातुओं को ड्रम से बजाया जाता है तो एक विशेष प्रकार की ध्वनि उत्पन्न होती है।
- धातुएँ आमतौर पर कमरे के तापमान पर ठोस होती हैं।
धातुओं के रासायनिक गुण-
- सभी धातुएँ ऑक्सीजन के साथ मिलकर ऑक्साइड बनाती हैं।
- 4Na + O2-2Na2 (सोडियम मोनोऑक्साइड)
- 2Mg + O2-2MgO (मैग्नीशियम मोनोऑक्साइड)
- वे एसिड पर प्रतिक्रिया करते हैं, और अक्सर हाइड्रोजन गैस उत्सर्जित करते हैं।
- 2Na + HCl-2NaCl + H2|
अधातु के लिए भौतिक विशेषताएँ और गुण-
- ब्रोमीन को छोड़कर गैर-धातुएं, सामान्य तापमान पर ठोस के साथ-साथ गैस भी मौजूद होती हैं।
- अधातुएँ भंगुर होती हैं।
- अधिकांश अधातुओं में कोई विशेष चमक नहीं होती।
- अधातुएँ विद्युत एवं ऊष्मा की सुचालक नहीं होती हैं।
- जो धातुएँ अधातु नहीं हैं वे नरम हो सकती हैं।
- अधातुओं पर हथौड़े से प्रहार करने पर कोई ध्वनि उत्पन्न नहीं होती है।
- हाइड्रोजन के अलावा सभी धात्विक तत्व विद्युत ऋणात्मक होते हैं।
अधातुओं की रासायनिक विशेषताएँ
- अधातुएँ ऑक्सीजन के साथ जुड़कर अम्लीय ऑक्साइड बनाती हैं।
- C+ O2-CO2
- S+ O2-SO2
- अधातुएँ जल के साथ अभिक्रिया नहीं कर पाती हैं।
भौतिक गुणों की दृष्टि से अधातु और धातु के बीच अंतर
- धातुओं में एक विशिष्ट प्रकार की चमक होती है, जबकि अधातुओं में वह चमक नहीं होती। हालाँकि, ग्रेफाइट और आयोडीन में धात्विक चमक होती है।
- धातुएं आमतौर पर विद्युत धनात्मक होती हैं जबकि गैर-धातुएं आमतौर पर विद्युत ऋणात्मक होती हैं। केवल हाइड्रोजन विद्युत धनात्मक है।
- धातुएं आम तौर पर बिजली और गर्मी की कुशल संवाहक होती हैं जबकि गैर-धातुएं आमतौर पर बिजली और गर्मी की खराब संवाहक होती हैं। एकमात्र अपवाद ग्रेफाइट और हाइड्रोजन हैं। बिजली के लिए उत्कृष्ट कंडक्टर.
- धातुएँ सामान्य तापमान पर ठोस होती हैं। पारा एकमात्र ऐसा पदार्थ है जो सामान्य तापमान पर तरल हो सकता है। सामान्य तापमान पर अधातुएँ या तो ठोस होती हैं या गैस। सामान्य तापमान पर ब्रोमीन ही एकमात्र तरल पदार्थ है।
- धातुएँ लचीली और लचीली होती हैं, जबकि अधातुएँ लचीली नहीं होती हैं। अपवाद यह है कि प्लास्टिक सल्फर अत्यंत लचीला होता है।
- धातुओं का घनत्व अधिक होता है, जबकि अधातुओं का घनत्व कम होता है।
- धातुओं पर हथौड़े से प्रहार करने पर एक विशेष प्रकार की ध्वनि उत्पन्न होती है। दूसरी ओर, अधातुएँ a से टकराने पर टूट जाती हैं।
रासायनिक गुणों के कारण धातुओं और अधातुओं के बीच अंतर
- धातु के परमाणु धनायन बनाते हैं, जैसे K+ Na+, K++, आदि। अधातुओं के परमाणु ऋणायन बनाते हैं। जैसे-Cl-, Br-, S2- आदि।
- धातुओं के ऑक्साइड भौतिक होते हैं
- CaO + H2O- Ca(OH) 2
- दूसरी ओर, अधातुओं के ऑक्साइड अम्लीय होते हैं। वे पानी के साथ क्रिया करके अम्ल बनाते हैं।
- CO2 + H2O- H2CO3
रासायनिक बंधन:
अणु के परमाणुओं को जोड़ने वाले बल को रासायनिक बंधन के रूप में जाना जाता है।
विभिन्न रूपों में रासायनिक बंधन
- आयनिक बंधन या इलेक्ट्रोवेलेंट बंधन
- सहसंयोजक बंधन
इलेक्ट्रोवेलेंट बॉन्ड, जिसे आयनिक बॉन्ड के रूप में भी जाना जाता है, रासायनिक बंधन जो दो परमाणुओं के बीच एक से दूसरे में इलेक्ट्रॉनों के स्थानांतरण के कारण बनता है, उसे इलेक्ट्रोवेलेंट बॉन्ड के रूप में जाना जाता है, जिसे आयनिक बॉन्ड के रूप में भी जाना जाता है। इसे ध्रुवीय बंधन के रूप में भी जाना जाता है। जैसे बनने वाला सोडियम क्लोराइड
Na+ + Cl–→ Na+Cl–
विद्युत संयोजकता
किसी तत्व के परमाणु को आयन में बदलने के लिए खोए या प्राप्त किए गए इलेक्ट्रॉनों की संख्या, उस तत्व के लिए विद्युत संयोजकता के रूप में जानी जाती है। सोडियम क्लोराइड बनाने की प्रक्रिया में सोडियम परमाणु एक इलेक्ट्रॉन त्यागता है जबकि क्लोरीन परमाणु एक इलेक्ट्रॉन प्राप्त करता है। इस प्रकार सोडियम की विद्युत संयोजकता +1 है, जबकि क्लोरीन की विद्युत संयोजकता एक है। उसी के समान, तीन तत्वों Mg, Ca और Ox की संयोजकता 2 है।
सहसंयोजक बंधन
जब दो तत्व इलेक्ट्रॉनों को साझा करके अपने अष्टक पूरा करते हैं, तो उनके बीच के रासायनिक बंधन को सहसंयोजक बंधन कहा जाता है।
सहसंयोजक बंधन तीन प्रकार के होते हैं।
- एकल सहसंयोजक बंधन
- दोहरा सहसंयोजक बंधन
- ट्रिपल सहसंयोजक बंधन
एकल सहसंयोजक बंधन –
यदि दो परमाणुओं के बीच इलेक्ट्रॉनों का केवल एक जोड़ा स्थित होता है तो उनके बीच बनने वाले बंधन को एकल सहसंयोजक बंधन कहा जाता है। हाइड्रोजन अणुओं का निर्माण
मीथेन अणु का निर्माण
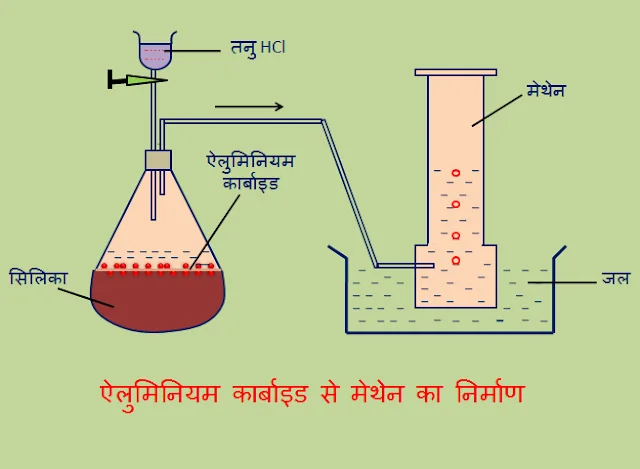
दोहरा सहसंयोजक बंधन –
यदि दो परमाणु मिलकर दो इलेक्ट्रॉनों को साझा करते हैं, तो उनके बीच बने बंधन को दोहरे सहसंयोजक बंधन के रूप में जाना जाता है।
कार्बन डाइऑक्साइड के बनने से कार्बन डाइऑक्साइड बनता है
ऑक्सीजन का निर्माण
ट्रिपल सहसंयोजक बंधन,
जिसे ट्रिपल बॉन्ड के रूप में भी जाना जाता है, तब होता है जब टकराने वाले परमाणु प्रत्येक में तीन इलेक्ट्रॉनों को साझा करते हैं, इन परमाणुओं के बीच बनने वाले बंधन को ट्रिपल सहसंयोजक बंधन के रूप में जाना जाता है।
खनिज
वे ठोस पदार्थ (तत्व और यौगिक) जिनमें पृथ्वी की परत के भीतर धातुएँ होती हैं, खनिज कहलाते हैं। जैसे सोडियम क्लोराइड (NaCl) और कैल्शियम कार्बोनेट (CaCO3) और अन्य। प्रकृति में पाए जाने वाले खनिज भण्डार हैं।
अयस्क
वह खनिज है जिसमें धातु प्रचुर मात्रा में होती है और जहां यह कम लागत पर आसानी से प्राप्त हो जाती है उसे अयस्क कहा जाता है। उदाहरण के लिए, बॉक्साइट (Al2O3. 2H2O) और मिट्टी (Al2O3. 2SiO2. 2H2O) दोनों एल्यूमीनियम के खनिज हैं।
धातुकर्म –
अयस्क से धातुओं को निकालने की प्रक्रिया तथा उन्हें शुद्ध करने की प्रक्रिया को धातुकर्म की प्रक्रिया कहा जाता है।
गैंग–
अयस्कों में पाए जाने वाले अवांछनीय पदार्थ जैसे रेत, कंकड़, मिट्टी के टुकड़े आदि को “गैंग” कहा जाता है।
अयस्क की सांद्रता –
खनिज के भीतर की अशुद्धियों को दूर करने की प्रक्रिया को अयस्क की सांद्रता कहा जाता है।
निस्तापन,
पिघलने बिंदु से कम तापमान पर अयस्क से ऑक्साइड को उच्च तापमान में हवा की अनुपस्थिति या कमी में बदलने की प्रक्रिया को निस्तापन की प्रक्रिया कहा जाता है।
भर्जन–
पर्याप्त वायु आपूर्ति की स्थिति में ऑक्साइड जलाने वाले सल्फाइड अयस्क को बदलने की विधि को भर्जन कहा जाता है।
गालक:
गैलक गैलक एक रसायन है जिसे कैलक्लाइंड जले हुए अयस्क और कोक के साथ मिलाया जा सकता है और गर्म किया जा सकता है।
धातुमल:
ठोस अयस्क के भीतर अघुलनशील अशुद्धियों का मिश्रण होता है और अशुद्धियों को तरल में बदल देता है जिसे स्लैग कहा जाता है।
प्रगलन धातु:
ऑक्साइड को कोक के साथ गर्म करके धातु में बदलने की प्रक्रिया को प्रगलन के रूप में जाना जाता है।
जस्ता के प्रमुख अयस्क
- जिंक मिश्रण (ZnS)
- कैलामाइन (ZnCO3)
- जिंकाइट (ZnO)
पारे में प्रमुख खनिज सिनेबार है।
सबसे महत्वपूर्ण एल्युमीनियम अयस्क
- बॉक्साइट (Al2O3 . 2H2O)
- कोरंडम (Al2O3)
- क्रायोलाइट (Na3AlF6)
संक्षारण: धातु की सतह पर मौजूद हवा में जल वाष्प, कार्बन डाइऑक्साइड सल्फर डाइऑक्साइड और हाइड्रोजन सल्फर डाइऑक्साइड आदि की प्रतिक्रिया के कारण धातु के खराब होने की प्रक्रिया को संक्षारण कहा जाता है।
संक्षारण को रोकने के लिए निवारक उपाय
- धातु की सतह पर लेप करके सामग्री की बाहरी सतह पर वार्निश या ग्रीस की एक पतली परत लगाकर संक्षारण को धीमा किया जा सकता है।
- रंगाई करके – धातु की सतह को किसी एसिड-प्रतिरोधी पेंट से पेंट करने से धातुओं में संक्षारण को रोका जाता है।
- जस्तीकरण करके– धातु को पिघले हुए जिंक में डुबाकर, किसी वस्तु के बाहर जिंक का एक इमल्शन बनाया जाता है। इसकी वजह से जंग लगने से बचा जा सकता है.
- विद्युतलेपन द्वारा– एक ऐसी विधि है जिसके द्वारा किसी धातु को विद्युतलेपन द्वारा किसी अन्य धातु के साथ सुरक्षित करके संक्षारण से बचाया जा सकता है।
मिश्र धातु
एक सजातीय संयोजन है जिसमें दो या दो से अधिक विभिन्न धातुएँ या अधातु शामिल होते हैं और एक धातु को मिश्र धातु के रूप में जाना जाता है।
उदाहरण के लिए यह जस्ता और तांबे से बना एक मिश्र धातु है।
मिश्रधातु के गुण
वे अपने घटकों की तुलना में अधिक टिकाऊ होते हैं।
वे संक्षारण अवरोधक भी हैं।
उनके विद्युत घटकों का पिघलने का तापमान और चालकता उनके समकक्षों की तुलना में कम है। उदाहरण के लिए, पीतल बिजली का बहुत अच्छा सुचालक नहीं है, जबकि तांबा अपने घटक में बिजली का बहुत अच्छा सुचालक है।
घटकों की तुलना में उनके उत्पादों की गुणवत्ता में सुधार हुआ है।
इसे भी पढ़े !!!!
Bihar Board Class 10th Chemistry Notes Solution in Hindi
अध्याय 1 रासायनिक अभिक्रियाएँ एवं समीकरण
अध्याय 2 अम्ल, क्षारक एवं लवण
अध्याय 3 धातु एवं अधातु
अध्याय 4 कार्बन एवं इसके यौगिक
अध्याय 5 तत्वों का आवर्त वर्गीकरण
Bihar Board Class 10th Biology Notes Solution in Hindi
अध्याय 6 जैव प्रक्रम
अध्याय 7 नियंत्रण एवं समन्वय
अध्याय 8 जीव जनन कैसे करते है
अध्याय 9 अनुवांशिकता एवं जैव विकास
अध्याय 14 उकर्जा के स्रोत
अध्याय 15 हमारा पर्यावरण
अध्याय 16 प्राकृतिक संसाधनों का प्रबंधन
Bihar Board Class 10th Physics Notes Solution in Hindi
अध्याय 10 प्रकाश-परावर्तन तथा अपवर्तन
अध्याय 11 मानव नेत्र एवं रंगबिरंगा संसार
अध्याय 12 विद्युत
अध्याय 13 विद्युत धारा का चुम्बकीय प्रभाव
Bihar Board Class 10 Science Notes Solutions in Hindi
आपको Class 10 Science Notes के सभी पाठ पढ़ने में आनंद आएगा। इसे पढ़ने के बाद आप उच्च अंक प्राप्त करेंगे। ये पाठ बहुत ही सरल भाषा में लिखे गए हैं ताकि आप सभी को समझने में आसानी से आ सके । Class 10 Science Notes Book अध्याय की प्रत्येक पंक्ति को सरल तरीके से समझाया गया है। आप नीचे दिए गए कमेंट बॉक्स पर क्लिक करके Class 10 Science Notes Book के किसी भी पाठ के बारे में पूछ सकते हैं। यदि आप अन्य विषयों के बारे में और अधिक पढ़ना चाहते हैं तो आप हमें टिप्पणी बॉक्स में भी बता सकते हैं। आपका बहुत-बहुत धन्यवाद।

