इस पोस्ट में हम Bihar board class 9 science chapter 4 notes in hindi Solutions परमाणु की संरचना के बारे में चर्चा कर रहे हैं। यदि आपके पास इस अध्याय से संबंधित कोई प्रश्न है तो आप कमेंट बॉक्स में टिप्पणी करें
यह पोस्ट बिहार बोर्ड परीक्षा के दृष्टिकोण से बहुत महत्वपूर्ण है। इसे पढ़ने से आपकी पुस्तक के सभी प्रश्न आसानी से हल हो जायेंगे। इसमें सभी पाठों के अध्यायवार नोट्स उपलब्ध कराये गये हैं। सभी विषयों को आसान भाषा में समझाया गया है।

ये नोट्स पूरी तरह से NCERTऔर SCERT बिहार पाठ्यक्रम पर आधारित हैं। इसमें विज्ञान के प्रत्येक पाठ को समझाया गया है, जो परीक्षा की दृष्टि से बहुत महत्वपूर्ण है। इस पोस्ट को पढ़कर आप बिहार बोर्ड कक्षा 9 विज्ञान के किसी भी पाठ को आसानी से समझ सकते हैं और उस पाठ के प्रश्नों का उत्तर दे सकते हैं।
परमाणु की संरचना – class 9 science chapter 4 notes in hindi
परमाणु :- परमाणु पदार्थ के निर्माण खंड हैं । यह पदार्थ की सबसे छोटी इकाई है जो तीन उप- परमाणु कणों से मिलकर बनी होती है : प्रोटॉन , न्यूट्रॉन और इलेक्ट्रॉन ।
इससे पहले डाल्टन ने कहा था कि परमाणु अविभाज्य है यानी आगे विभाजित नहीं किया जा सकता है जो कि उप – परमाणु कणों की खोज से गलत साबित हुआ है ।
परमाणु के तीन अवपरमाणुक कण (subatomic particles) होते हैं |
- प्रोट्रॉन (Protron)
- न्यूट्रॉन (Neutron)
- इलेक्ट्रान (Electron)
परमाणु के अन्दर उपस्थित ये अवपरमाणुक कणों में से दो कण आवेशित होते हैं
1. प्रोट्रान (Protron): यह धन आवेशित (+) कण होता है जो परमाणु के नाभिक (भीतरी भाग ) में रहता है | यह तत्व के सभी रासायनिक गुण धर्म को प्रदर्शित करता है | परमाणु में प्रोट्रान के घटने या बढ़ने से उसके रासायनिक गुणधर्म भी बदल जाते हैं |
- प्रोट्रॉन को p+ से दर्शाया जाता है |
- इनका द्रव्यमान इलेक्ट्रान k अपेक्षा लगभग 2000 गुणा अधिक होता है |
- प्रोट्रॉन का द्रव्यमान 1 इकाई और इसका आवेश +1 लिया जाता है |
- इन्हें असानी से नहीं निकाला जा सकता है क्योंकि ये नाभिक में रहते है यदि इन्हें निकाला गया तो नाभिक टूट जायेगा |
प्रोटॉन की खोज :- ई . गोल्डस्टीन ने उनके द्वारा प्रसिद्ध एनोड किरणों या केनाल किरणों के प्रयोग द्वारा परमाणु में धनावेशित कण यानि प्रोटॉन की खोज की ।
प्रोटॉन के कुछ तथ्य :-
- प्रोटॉन पर आवेश = +1.6 × 10⁻¹⁹C
- प्रोटॉन का द्रव्यमान = 1.673 × 10⁻²⁷Kg
- प्रोटॉन का द्रव्यमान = 1840 x इलेक्ट्रॉन का द्रव्यमान
2. न्यूट्रॉन (Neutron): न्यूट्रॉन परमाणु के नाभिक में उपस्थित बिना आवेश वाला कण है जिस पर कोई आवेश नहीं होता है |
- हाइड्रोजन को छोड़कर ये सभी परमाणुओं के नाभिक में होते हैं।
- समान्यतः, न्यूट्राॅन को ‘n’ से दर्शाया जाता है।
परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटाॅन और न्यूट्रॉन के द्रव्यमान के योग के द्वारा प्रकट किया जाता है।
न्यूट्रॉन की खोज :- 1932 में जेम्स चैडविक ने हल्के तत्वों ( जैसे- लीथियम , बोरोन इत्यादि ) की कणों से साथ भिड़ंत करवाई , जिसके कारणवश एक नए कण जिनका द्रव्यमान प्रोटॉन के बराबर था , तथा वे आवेश रहित थे , की उत्पत्ति सिद्ध की । इन कणों को न्यूट्रॉन का नाम दिया गया ।
न्यूट्रॉन , हाइड्रोजन के प्रोटियम समस्थानिक में नहीं होते हैं । इलेक्ट्रॉन का द्रव्यमान प्रोटोन तथा न्यूट्रॉन के द्रव्यमान से अत्यधिक कम है , इसलिए परमाणु का द्रव्यमान , प्रोटोन और न्यूट्रॉन के द्रव्यमानों का योग होगा ।
3. इलेक्ट्रान (Electron): परमाणु: यह ऋण आवेशित (-) कण है जो नाभिक के चारों ओर भिन्न-भिन्न और निश्चित कक्षाओं में चक्कर काटते हैं |
- इसे e– द्वारा दर्शाया जाता है |
- इलेक्ट्रान का द्रव्यमान नगण्य और आवेश -1 लिया जाता है |
इलेक्ट्रॉन्स को आसानी से निकाला जा सकता है
इलैक्ट्रॉन की खोज :- इलैक्ट्रॉन की खोज कैथोड किरणें की सहायता से जे.जे.टामसन ने की । टामसन ने केथोड किरणों की मदद से परमाणु में इलैक्ट्रॉन की उपस्थिति के बारे में बताया ।
इलेक्ट्रान के बारे में कुछ महत्वपूर्ण तथ्य :-
- इलेक्ट्रॉन पर आवेश = -1.6×10⁻¹⁹C
- इलेक्ट्रॉन पर द्रव्यमान = 9.1 × 10⁻³¹ Kg
केनाल किरणें : केनाल किरणें विसर्जन नलिका के एनोड से निकलने वाले धन आवेशीत कणों की धारा है, जब बहुत ही कम दाब पर गैस में से विद्युत धारा प्रवाहित की जाती है।
उदासीन परमाणु: समान्यत: कोई भी परमाणु उदासीन होता है क्योंकि परमाणु में धन प्रोट्रानो की संख्या ऋण इलेक्ट्रानों की संख्या के बराबर होता है यही कारण है कि किसी भी परमाणु पर नेट आवेश शून्य होता है और परमाणु उदासीन होता है | जैसे ऑक्सीजन (O) के परमाणु में 8 धन प्रोट्रान होते है उतनी ही ऋण इलेक्ट्रान होते है |
परमाणु मॉडल :- उप – परमाणुविक कणों जैसे की इलेक्ट्रॉन , प्रोटॉन और न्यूट्रॉन की खोज के उपरान्त परमाणु के विभिन्न मॉडल दिए गए । उनमें से कुछ परमाणु के मॉडल इस तरह से हैं :-
- ( a ) टॉमसन का परमाणु मॉडल
- ( b ) रदरफोर्ड का परमाणु मॉडल
- ( c ) बोर का परमाणु मॉडल
इन दिनों ‘ क्वांटम यांत्रिक परमाणु मॉडल ‘ , वैज्ञानिक तौर पर सही पाया गया है और इसी मॉडल को स्वीकृति दी गई है । इस मॉडल को उच्च कक्षाओं में पढ़ाया जाएगा ।
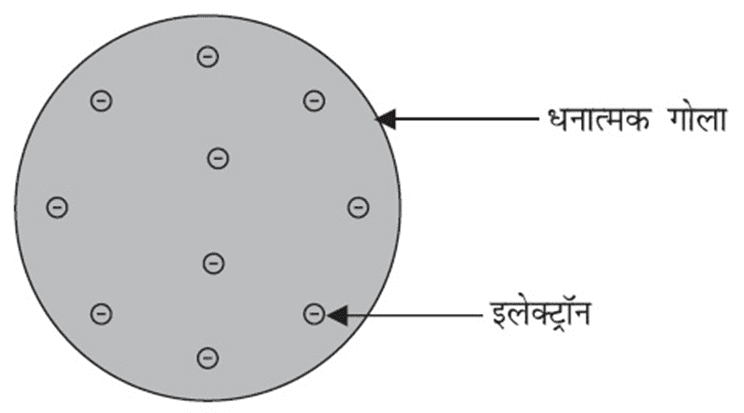
(a) टॉमसन का परमाणु मॉडल :- टॉमसन के इस परमाणु मॉडल को ‘ कटा तरबूज मॉडल ‘ कहते हैं । टॉमसन के इस मॉडल में परमाणु में धन आवेश तरबूज के खाने वाले लाल भाग की तरह बिखरा है जबकि इलेक्ट्रॉन धनावेशित गोले में तरबूज के बीज की भांति धंसे हैं ।
हालांकि इस मॉडल ने परमाणु के आवेशरहित अभिलक्षण की विवेचना की पर कुछ वैज्ञानिक को यह मॉडल नहीं समझ आया इसलिए इसे नकार दिया गया ।
टाॅमसन ने प्रस्तावित किया किः
- परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॅान उसमें ध्ँसे होते हैं।
- ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
टॉमसन के परमाणु मॉडल की कमियाँ/सीमाएँ:
(i) दुसरे वैज्ञानिकों द्वारा किये गए प्रयोगों को इस मॉडल के द्वारा नहीं समझाया जा सका |
परमाणु नाभिक की खोज: परमाणु केन्द्रक की खोज रदरफोर्ड ने की, उन्होने तेज गति से चल रहे अल्फा कणों को सोने की पतली पन्नी पर टकराया गया । जिसके परिणाम से पता चला कि परमाणु में अधिकांश भाग खाली है जहाँ से अल्फा कण बीना टकराये पन्नी से सीधे निकल गये परन्तु कुछ अल्फा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए। जहाँ से ये कण विक्षेपित हुए थे, दरअसल वह परमाणु का नाभिक अर्थात केन्द्रक था । इसप्रकार रदरफोर्ड ने नाभिक की खोज की ।
(b) रदरफोर्ड का परमाणु मॉडल :- रदरफोर्ड ने अपने प्रयोग में , तेज से चल रहे अल्फा ( हीलियम नाभिक ₂He₄ ) कणों को सोने के पन्नी से टक्कर कराई ।
रदरफोर्ड के प्रयोग के परिणाम :-
- ज्यादातर अल्फा कण बिना मुड़े सोने की पन्नी से सीधे निकल गए ।
- कुछ अल्फा कण निम्न कोणों से मुड़े ।
- प्रत्येक 12000 कणों में से एक कण वापस आ गया ।
रदरफोर्ड के परमाणु नाभकीय मॉडल के लक्षण: रदरफोर्ड के प्रयोगो के आधार पर परमाणु का नाभकीय – माॅडल के निम्नलिखित लक्षण थे।
- परमाणु का केन्द्र धन आवेशीत होता है जिसे नाभिक कहा जाता है।
- एक परमाणु का लगभग सम्पूर्ण द्रव्यमान नाभिक में होता है।
- इलेक्ट्रान नाभिक के चारो ओर निश्चित कक्षाओं में चक्कर लगाते है।
- नाभिक का आकार परमाणु की तुलना में काफी कम होता हैं।
- परमाणु में इलेक्ट्राॅनो की संख्या प्रोट्राॅनो की संख्या के बराबर होता है।
रदरफोर्ड के प्रयोग के आधार पर निष्कर्ष :-
- अपने प्रयोग के परिणामों के आधार पर रदरफोर्ड ने निम्नलिखित निष्कर्ष निकाले :-
- परमाणु के भीतर का अधिकतर भाग खाली है क्योंकि अधिकतर अल्फा कण बिना मुड़े सोने की पन्नी से बाहर निकल जाते हैं ।
- परमाणु के बीच एक धनावेशित गोला जिसे नाभिक कहा जाता है , क्योंकि 12000 में से एक a – कण वापस आ गया ।
क्योंकि ज्यादातर कण सोने की पन्नी से सीधे निकल गए और कुछ ही कणों में झुकाव देखा गया , इस आधार पर यह निष्कर्ष निकाला कि परमाणु के भीतर ज्यादातर भाग खाली है और नाभिक इस खाली भाग के बहुत छोटे से भाग में मौजूद होता है ।
नाभिक का आयतन 10⁻⁵ गुणा परमाणु के आयतन के बराबर होता है ।
परमाणु का सम्पूर्ण द्रव्यमान उसके नाभिक में होता है ।
रदरफोर्ड के प्रयोग की विशेषताएँ :- अपने प्रयोग के आधार पर , रदरफोर्ड ने परमाणु का मॉडल प्रस्तुत किया जिसमें निम्नलिखित विशेषताएँ थीं
- परमाणु का केन्द्र धनावेशित होता है जिसे नाभिक कहा जाता है ।
- एक परमाणु का सम्पूर्ण द्रव्यमान नाभिक में होता है ।
- इलेक्ट्रॉन नाभिक के चारों ओर वलयकार मार्ग में चक्कर लगाते हैं ।
- नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है ।
रदरफोर्ड के परमाणु मॉडल की कमियाँ :- रदरफोर्ड के अनुसार इलेक्ट्रॉन नाभिक के चारों ओर वलयाकार मार्ग में चक्कर लगाते हैं , किन्तु आवेशित होने के कारण , ये कण अपनी ऊर्जा निरन्तर खोते रहते हैं जिसके कारण वे अंततः नाभिक में प्रवेश कर परमाणु को अस्थिर बनाते हैं ।
यह रदरफोर्ड परमाणु मॉडल की सबसे बड़ी कमी थी , जिसे रदरफोर्ड समझा नहीं पाया ।
बोर का परमाणु मॉडल :- रदरफोर्ड मॉडल की कमी का निवारण बोर के परमाणु मॉडल से हुआ । नील्स बोर ने 1912 में परमाणु के बारे में अपना मॉडल प्रस्तुत किया जिसमें निम्नलिखित तथ्य मौजूद थे :-
- इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं , जिन्हें इलेक्ट्रॉन की निर्धारित कक्षा कहते हैं ।
- इन निर्धारित कक्षाओं में चक्कर लगाते हुए , ये इलेक्ट्रॉन अपनी ऊर्जा का विकिरण नहीं करते ।
- किसी भी परमाणु के इलेक्ट्रॉन की ऊर्जा में बदलाव , इन इलेक्ट्रॉन की कक्षाओं में स्थानांतरण के कारण होता है ।
इलेक्ट्रोनिक विन्यास (Electronic Configuration): किसी परमाणु के विभिन्न कोशों में इलेक्ट्रोनों के वितरण को इलेक्ट्रोनिक विन्यास कहते हैं |
हाइड्रोजन का इलेक्ट्रॉनिक संरचना:
हाइड्रोजन में 1 इलेक्ट्रान होता है अत: इसके बाह्यतम कक्षा K में केवल एक ही इलेक्ट्रान रहता है |
कार्बन के परमाणु का इलेक्ट्रॉनिक संरचना:
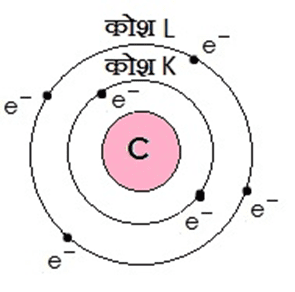
कार्बन के पास कुल 6 इलेक्ट्रॉन्स होते है तो इसके सबसे भीतरी कक्षा K में 2 इलेक्ट्रान रहता है और बहरी कक्षा L में शेष बचे 4 इलेक्ट्रॉन्स रहता है |
ये कोश होते हैं :
K, L, M, N आदि
कोश K में अधिकतम 2 इलेक्ट्रॉन्स रह सकते हैं |
कोश L में अधिकतम 8 इलेक्ट्रॉन्स रह सकते हैं |
कोश M में अधिकतम 18 इलेक्ट्रॉन्स रह सकते हैं और
कोश N में अधिकतम 32 इलेक्ट्रॉन्स रह सकते हैं |
कोशों में अधिकतम इलेक्ट्रॉन्स को रखने के लिए एक सूत्र है: 2n2
जिसके आधार अधिकतम इलेक्ट्रॉन्स की संख्या ज्ञात की जाती है :
जैसे पहले कोश K के लिए : 2(1)2 = 2 x 1 = 2
दुसरे कोश L के लिए : 2(2)2 = 2 x 4 = 8
तीसरे कोश M के लिए : 2(3)2 = 2 x 9 = 18
चौथे कोश N के लिए : 2(4)2 = 2 x 16 = 32
संयोकजता (valency): किसी परमाणु के बाह्यतम कक्षा में उपस्थिति संयोजी इलेक्ट्रॉन्स की संख्या को उस तत्व की संयोजकता कहते हैं |
जैसे :
कुछ तत्वों का इलेक्ट्रॉनिक विन्यास और उनकी संयोजकता:
जैसे किसी तत्व के बाह्यतम कक्षा में 1 इलेक्ट्रॉन् है तो उसकी संयोजकता 1 ही होगी | यदि उसके बाह्यतम कक्षा में 2 , 3 या 4 है तो उसकी संयोजकता भी क्रमश: 2, 3 या 4 होगी | यदि बाह्यतम कोश में 5, 6 या 7 इलेक्ट्रॉन्स है तो संयोजकता निम्नानुसार ज्ञात किया जाता है |
- जब बाह्यतम कोश में 5 हो तो संयोजकता = 8 – 5 = 3
- जब बाह्यतम कोश में 6 हो तो संयोजकता = 8 – 6 = 2
- जब बाह्यतम कोश में 7 हो तो संयोजकता = 8 – 7 = 1
- जब बाह्यतम कोश में 8 हो तो संयोजकता = 8 – 8 = 0
तालिका : देखे
| तत्व का नाम | प्रतीक | परमाणु संख्या | प्रोट्रॉनों की संख्या | न्यूट्रॉनों की संख्या | इलेक्ट्रोनों की संख्या | इलेक्ट्रोनिक विन्यास K L M N | संयोजकता |
| हाइड्रोजन | H | 1 | 1 | – | 1 | 1 | 1 |
| हीलियम | He | 2 | 2 | 2 | 2 | 2 | 0 |
| लिथियम | Li | 3 | 3 | 3 | 3 | 2 1 | 1 |
| बेरिलियम | Be | 4 | 4 | 4 | 4 | 2 2 | 2 |
| बोरान | B | 5 | 5 | 5 | 5 | 2 3 | 3 |
| कार्बन | C | 6 | 6 | 6 | 6 | 2 4 | 4 |
| नाइट्रोजन | N | 7 | 7 | 7 | 7 | 2 5 | 3 |
| ऑक्सीजन | O | 8 | 8 | 8 | 8 | 2 6 | 2 |
| फ्लोरीन | F | 9 | 9 | 9 | 9 | 2 7 | 1 |
| नियाँन | Ne | 10 | 10 | 10 | 10 | 2 8 | 0 |
| सोडियम | Na | 11 | 11 | 11 | 11 | 2 8 1 | 1 |
| मैग्नेशियम | Mg | 12 | 12 | 12 | 12 | 2 8 2 | 2 |
| एल्युमीनियम | Al | 13 | 13 | 13 | 13 | 2 8 3 | 3 |
| सिलिकॉन | Si | 14 | 14 | 14 | 14 | 2 8 4 | 4 |
| फोस्फोरस | P | 15 | 15 | 15 | 15 | 2 8 5 | 3, 5 |
| सल्फर | S | 16 | 16 | 16 | 16 | 2 8 6 | 2 |
| क्लोरीन | Cl | 17 | 17 | 17 | 17 | 2 8 7 | 1 |
| आर्गन | Ar | 18 | 18 | 18 | 18 | 2 8 8 | 0 |
परमाणु संख्या :- किसी भी परमाणु में प्रोटॉन की कुल संख्या का मान उसकी परमाणु संख्या कहलाती है ।
- परमाणु संख्या किसी भी परमाणु का परिचायक होता है , इसमें बदलाव किसी भी परमाणु के स्वरूप को बदल देता है ।
- परमाणु संख्या , ‘ z ‘ द्वारा प्रदर्शित की जाती है ।
- किसी भी अनावेशित परमाणु में , प्रोटॉन तथा इलेक्ट्रॉन की संख्या बराबर होती है ।
द्रव्यमान संख्या :- द्रव्यमान संख्या किसी परमाणु के नाभिक में मौजूद प्रोटोन तथा न्यूट्रॉन की संख्या का जोड़ होती हैं ।
- द्रव्यमान संख्या ‘ A ‘ द्वारा प्रदर्शित किया जाता है ।
संयोजकता :- बोरबरी नियम के अनुसार हमें ज्ञात है कि किसी भी परमाणु के अंतिम कोश में ‘ 8 ‘ इलेक्ट्रॉन भरे जा सकते हैं । हर तत्व अपनी बाहरी कोश में 8 इलेक्ट्रॉन भरने के लिए , इलेक्ट्रॉन को अपने में से मुक्त या अन्य तत्वों में से इलेक्ट्रॉन को ग्रहण करते हैं ।
- 8 इलेक्ट्रॉन अपने अंतिम कोश में रखने हेतु जो भी इलेक्ट्रॉन कोई तत्व लेता या देता है इलेक्ट्रान की इस संख्या जो लेने देने में उपयोग होती है । उसे संयोजकता कहते हैं ।
समस्थानिक :- एक ही तत्व के ऐसे परमाणु जिनके परमाणु संख्या बराबर हो पर द्रव्यमान संख्या भिन्न हों । ऐसे परमाणु समस्थानिक कहलाए जाते हैं ।
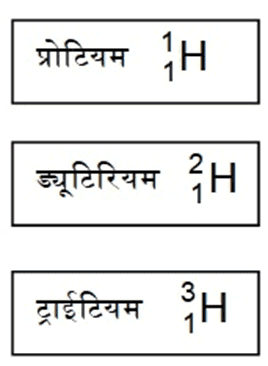
जैसे- हाइड्रोजन के तीन समस्थानिको के नाम है :
- प्रोटियम (H)
- ड्यूट्रीयम (D)
- ट्राईटियम (T)
ये तीन समस्थानिक हाइड्रोजन परमाणु के स्पीशीज हैं |
इसी प्रकार कार्बन के भी तीन समस्थानिक हैं –
इसी प्रकार कार्बन के भी तीन समस्थानिक हैं –

क्लोरिन के समस्थानिक:
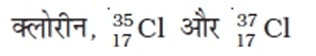
किसी तत्व का प्रत्येक समस्थानिक शुद्ध पदार्थ होता है। समस्थानिकों के रासायनिक गुण समान लेकिन भौतिक गुण अलग-अलग होते हैं।
समस्थानिक का उपयोग :-
- यूरेनियम समस्थानिक का उपयोग परमाणु संयंत्र में ईंधन के तौर पर किया जाता है ।
- कोबाल्ट का समस्थानिक कैंसर के उपचार में उपयोग किया जाता है ।
- आयोडीन के समस्थानिक का उपयोग घेंघा के उपचार में किया जाता है ।
- C-14 ( कार्बन – 14 ) का उपयोग कार्बन डेटिंग में किया जाता है ।
समभारिक :- अलग – अलग तत्वों के ऐसे परमाणु जिनकी द्रव्यमान संख्याएँ एक जैसी हों परन्तु परमाणु संख्या भिन्न हो , समभारिक कहलाए जाते हैं ।

